HASEGAWA LETTER 2022年( No.40 )/ 2022.01


OUR 技術レポート
バイオ技術を用いた
セスキテルペノイド合成法
〜鉄還元酵素と鉄キレート触媒の
組み合わせによる新規合成法〜
ごく微量で天然の果物や花の香気に寄与しているセスキテルペノイド。
微量香気成分の工業的利用にはそれぞれの化合物に適した合成法が必要であるが、そこでは効率性に加えて、持続可能なモノづくりが大きな価値をもつ。
今回、循環型の反応を実現可能なバイオ技術を活用することで、酵素と鉄触媒を組み合わせた新たなセスキテルペノイド合成法を開発した。
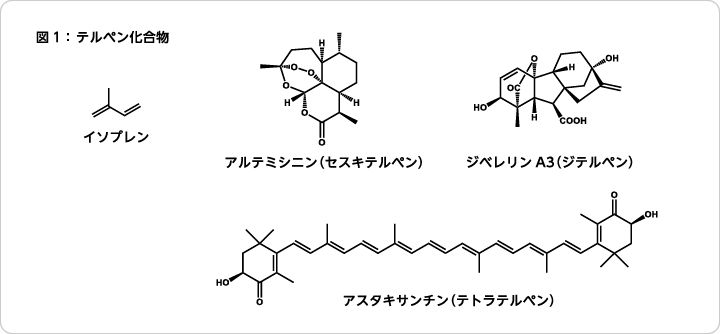
香料として利用されるテルペン化合物
- ●テルペン化合物とは
- テルペン化合物は、植物、哺乳類、昆虫、菌類などの自然界の幅広い生体中に存在する。その構造多様性から、医薬、農薬、香料、色素、燃料等のさまざまな産業で活用されており、機能性化合物が数多く見いだされている1)。
テルペン化合物は、イソプレン(C5)を構成単位とする化合物群の総称であり、イソプレンユニットの数によって分類される。モノテルペン(monoterpene;
C10)、セスキテルペン(sesquiterpene;
C15)、ジテルペン(diterpene;
C20)、セスタテルペン(sesterterpene;
C25)、トリテルペン(triterpene;
C30)、テトラテルペン(tetraterpene;
C40)と呼ばれ、テルペン化合物は知られているだけで60,000種を超える巨大化合物群である。
例えば、マラリアの治療薬として知られるアルテミシニン(artemisinin)はキク科の植物から抽出されるセスキテルペン、植物ホルモンの一種であり農産物の成長調整剤として用いられるジベレリン(gibberellin)類はジテルペン、赤色を呈する色素成分であり高い抗酸化性からサプリメントやスキンケア化粧品に利用されるアスタキサンチン(astaxanthin)はテトラテルペンに分類される(図1)。
香料分野においては、モノテルペンおよびセスキテルペノイドが重要な成分であり、特にセスキテルペノイドには特徴的な香気を有する種類が報告されている。
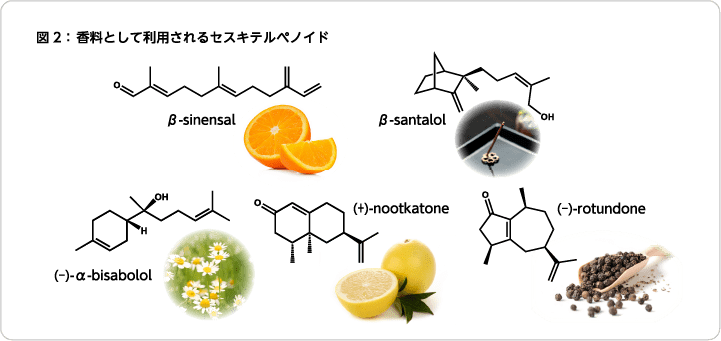
- ●香料として有用なセスキテルペノイド
- テルペン化合物の中で、炭素と水素だけで構成されるものをテルペン炭化水素(terpene hydrocarbon)、そこに主に酸素原子が組み込まれた誘導体はテルペノイド(terpenoid)と定義される。テルペノイドは酸素が組み込まれたことによって分子の極性が変化し、親水性および生体適合性の向上とそれに応じた生理活性が発現するようになる。香料として利用されるテルペン化合物に関してもテルペノイドに香気を発現する種類が多く、分子の揮発性の関係から、モノテルペノイドおよびセスキテルペノイドが重要な香気成分である。
その中でもセスキテルペノイドには特徴的な香気を有する種類があり、例えばオレンジの甘い果汁感に寄与するβ-sinensal、香木の一種であるビャクダンの香気を特徴づけるβ-santalol、カモミールの甘い香りを有する(−)-α-bisabolol、グレープフルーツの香気を特徴づける(+)-nootkatone、黒コショウやシラー種ワインのウッディーな香気を特徴づける(−)-rotundoneなどが挙げられる(図2)。(−)-rotundoneについては、においを感じられる下限濃度(閾値)が8pptと非常に低濃度であることに加え2)、オレンジ、リンゴ、マンゴー、グレープフルーツといった果物の香気中に閾値付近の濃度で含まれている。この微量重要香気成分である(−)-rotundoneを香料として利用することで、フルーツフレーバーの天然感や香味増強効果を得ることができる3,4)。
このようにセスキテルペノイドには香料として非常に有用な化合物が存在するが、その工業的利用においては安定な供給法を確立することが重要なポイントとなる。
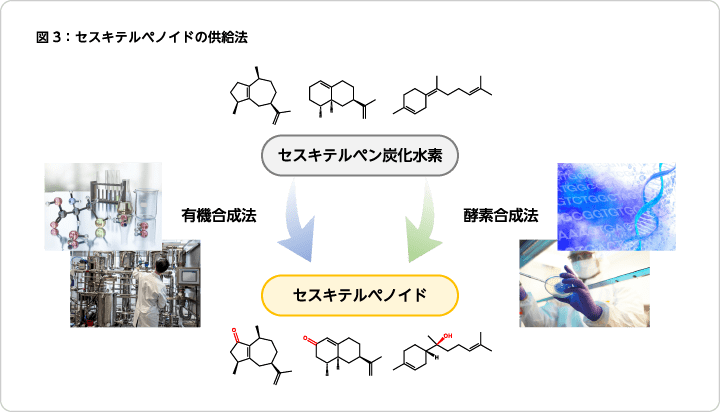
セスキテルペノイドの供給法
- ●セスキテルペノイドを供給するために
- セスキテルペノイドは自然界において、主に植物の二次代謝産物として産生される成分であるため、精油などの天然原料からの抽出物で検出される。しかし、精油を構成する揮発性成分は一般的にテルペン炭化水素が主であり、テルペノイドの含有量はわずかである場合が多い5)。そしてセスキテルペノイドはそこからさらに含量が絞られるため、特定のセスキテルペノイドを抽出法によって製造できる事例は非常に少ない。従って、合成的手法によって目的のセスキテルペノイドを製造することが現実的となるが、テルペン化合物の炭素骨格は複雑に環化や分岐しているため、これを一から構築することは効率的ではない。すなわち、天然原料由来のセスキテルペン炭化水素を土台として、セスキテルペノイドを酸化的に合成する手法が、その工業的利用において重要な役割を担うことになる。
セスキテルペノイドの工業的な酸化的合成は、有機合成法と酵素合成法の二つがある(図3)。 - ●有機合成法
- 第一の選択肢として挙げられるのは有機合成法である。香料化合物のほぼすべては有機化合物であり、セスキテルペノイドの合成においても基本的に有機合成法が適用可能である。この場合、適切な触媒、酸化剤や溶媒を選択することで、セスキテルペン炭化水素から目的のセスキテルペノイドが得られる。有機合成法には長年の香料研究・開発で培われてきたノウハウが蓄積されており、現在のさまざまな香料需要に応える基盤技術となっている。
一方で、近年重要視される持続可能な開発目標(Sustainable Development Goals, SDGs)の観点から同手法を見返した場合、いくつかの課題を見いだすこともできる。例えば重金属触媒を用いることによる環境負荷、腐食性や爆発性の酸化剤を用いることによる作業危険性などが挙げられる。もちろん同手法によってつくられた香料は、植物性タンパク質に代表される代替食素材の風味改善が可能であり、食資源不足という社会課題の解決策としてSDGsへの貢献が可能である。ただし製法の観点においては、高機能触媒などの技術進歩によりリスクを減らす対策も講じられているが、その導入には経済面や製造設備面からの制約が障壁となる場合がある。 - ●酵素合成法
- SDGsの観点から考察すると第二選択肢として注目されるのが、バイオテクノロジーによる酵素合成法である。セスキテルペノイドは天然に産生される化合物群であるため、その構造は非常に多岐にわたっているが、個々の化合物に応じた生合成経路が自然界には必ず存在する。そしてその反応様式は、常温常圧の穏やかな条件のもと、糖などの天然物を起点とする循環型システムである。従って、その生合成経路に準ずる製法を確立することができれば、工業利用に向けた多様なセスキテルペノイドのつくり分けに加えて、環境調和や作業安全性といったSDGsの理念に合致したモノづくりを目指すことが可能となる。
そこでわれわれは、早稲田大学理工学術院の木野邦器教授との共同研究において、セスキテルペノイドの酵素合成法の開発を目的として、セスキテルペン炭化水素をセスキテルペノイドに変換する酵素の探索に着手した。
酵素合成法へ
酵素探索と鉄キレート触媒の発見
- ●酵素探索の高いハードル
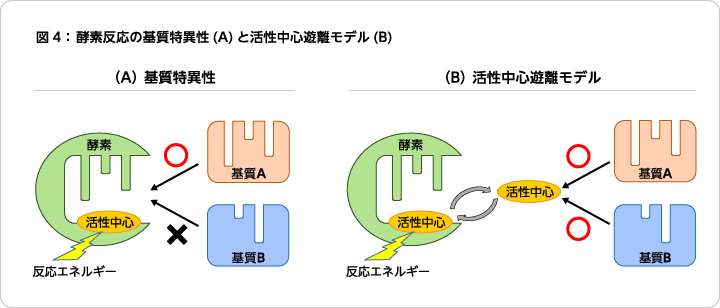
- 酵素合成法における重要な因子としては、「酵素の基質特異性」が挙げられる。基質とは酵素反応の原料化合物を指す用語であり、基質特異性とは「基質と酵素」を「カギとカギ穴」の関係に例えて説明される。このときの基質はカギ、酵素はカギ穴に例えられており、カギ穴である酵素内部の活性中心空間に形が当てはまる基質(カギ)でのみ反応が進行する、という性質を指す(図4A)。この性質は酵素反応の高い選択性を担保するものであるが、一方で形が合致しない基質では反応そのものが進行しないため、目的の反応に使用できる酵素を探索する場合には高いハードルとなる。事実、土壌スクリーニングや早稲田大学木野研究室が保有する酸化酵素ライブラリ―を用いて、セスキテルペン炭化水素の酸化活性を探索したが、目的の酸化酵素を見いだすことは残念ながらできなかった。
- ●鉄キレート触媒の発見
- しかし、この研究を進めていく中で、微生物細胞をセスキテルペン炭化水素に作用させた場合に、微弱かつ不安定ではあるもののグレープフルーツや黒コショウの微量重要香気成分である(+)-nootkatoneや(−)-rotundoneといったセスキテルペノイドが生成する結果が得られていた。この酸化活性の理由は当初不明であったが、検出頻度が比較的高かった大腸菌を用いて、菌体反応や細胞内成分の分画および補酵素応答性などの検証を一つずつ進めた結果、キレート状態の還元鉄Fe2+がセスキテルペン炭化水素の酸化に触媒として関与していることを見いだした。
この結果は、酸化酵素の探索を念頭に置いていた当初の予想とはまったく異なるものであった。しかしその一方で、細胞内におけるFe2+キレートの役割を考えると、酸化酵素の活性中心として酸化反応そのものに関与する性質が挙げられた6)。すなわち、本来ならば酵素内部の活性中心Fe2+キレートで進行する酸化反応について、条件を整えることで、遊離したFe2+キレートでも反応進行が可能、ということが判明した。これは酵素的酸化反応の自由度を大きく上げられることを示唆している。
そこでこの知見をもってわれわれは、図4Bに示すような、酸化酵素の活性中心を酵素の外側に抜き出す反応形式が成立するのではないかと考えた。活性中心が酵素内部にとどまっている場合は基質特異性の制限を受け、カギとカギ穴の関係から、形が一致しない基質は反応させることができない(図4A)。これに対して、活性中心を酵素から遊離させた場合は基質特異性の制限を回避することができ、本来カギ穴には一致しない基質でも反応を進行させることが可能となる(図4B)。この場合、触媒として遊離させる活性中心Fe2+キレートの構造とそれを可能にする酵素の選定が重要であると考え、自然界に存在する酸化酵素の構造をヒントとして、図4Bのコンセプト実現に向けた候補の絞り込みを行った。
鉄還元酵素と鉄キレート触媒を
組み合わせた新しい酸化反応系
- ●酸化酵素の鉄キレート構造と微生物のFe取り込み
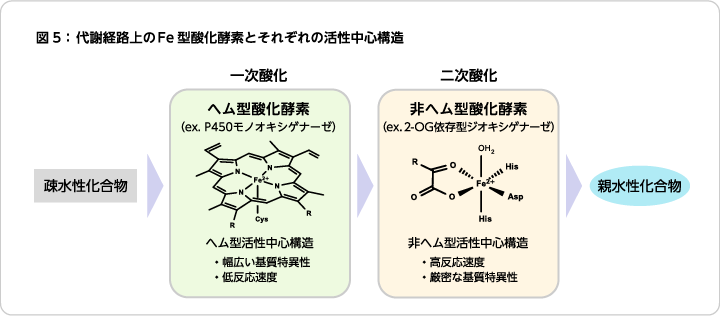
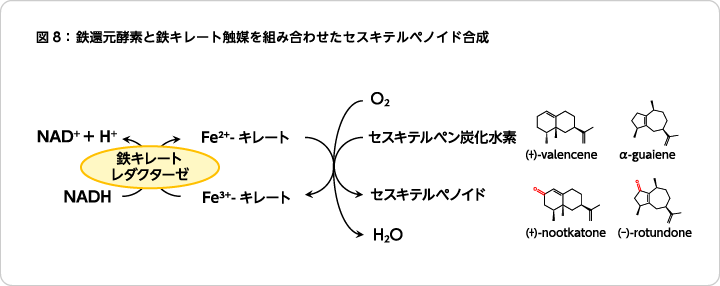
- 酸化酵素の活性中心金属としては銅(Cu)、亜鉛(Zn)などのさまざまな種類が報告されているが、最も普遍的に存在する種類は鉄(Fe)である6)。Fe型酸化酵素は中心のキレート構造から2種類に大別され、ポルフィリン配位子で構成されるヘム型と、ポルフィリン以外の配位子で構成される非ヘム型に分けられる。これらFe型酸化酵素は生体内の代謝経路上で連続した役割を担っており、基質特異性は広いが反応が遅いヘム型と基質特異性は狭いが反応が速い非ヘム型、これらによる連続的な酸化を経て代謝産物がつくり出される(図5)7)。この点、活性中心を遊離させる反応形式においては、基質特異性の制限を回避可能であることが大きなメリットであるため、調製が容易であり、かつ反応が速い非ヘム型の活性中心Fe2+キレートを模倣のモデルに選択した。
- ●酵素「鉄キレートレダクターゼ」に着目
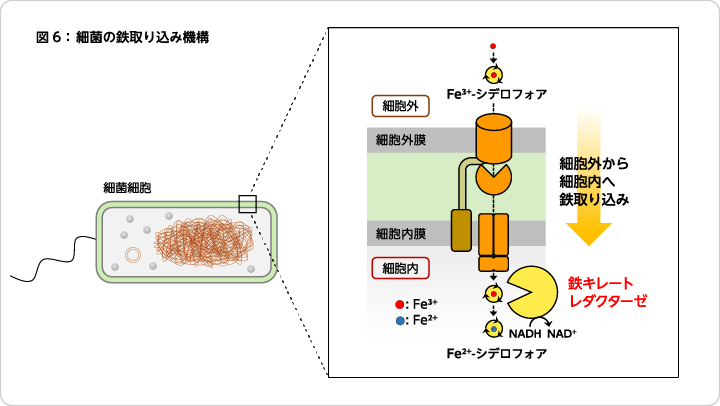
- 次いで、Fe2+キレートを供給する酵素に関しては、微生物の鉄取り込みに関わる機能に着目した。遷移金属である鉄は2+と3+のイオン価数をとり、鉄を生体内で利用するためには還元状態のFe2+が必要である。しかし、土壌などの自然環境では、鉄は基本的に酸化状態のFe3+で存在している。このFe3+は水に非常にわずかしか溶解しないため、生物にとっては利用しにくい状態である。そこで大腸菌をはじめとした一部の微生物や植物は、「シデロフォア」と呼ばれる化合物種を細胞外に放出し、Fe3+とのキレートを形成させる。そしてそのFe3+キレートを細胞内に取り込むことで、効率的に周囲の鉄を回収するメカニズムを有している。そして、回収した鉄を細胞内で利用するために、シデロフォアを利用する生物種はFe3+キレートをFe2+キレートに還元する酵素「鉄キレートレダクターゼ」を有している(図6)8)。この鉄キレートレダクターゼは、まさしく図4Bの活性中心遊離モデルのコンセプトを実現できる酵素であったため、非ヘム型の鉄キレートと鉄キレートレダクターゼを用いて、実際にセスキテルペン炭化水素の酸化を試みた。
- ●鉄還元酵素と鉄キレート触媒を組み合わせた新しい酸化反応系
- 鉄キレートレダクターゼには大腸菌由来の酵素を選択し、鉄キレート触媒にはFe3+およびFe2+どちらに対しても安定な錯体を形成するEDTAを配位子としたFe-EDTAを用いた。この反応系では、酵素的還元反応のエネルギー源であるNADH存在下でFe3+-EDTAに鉄キレートレダクターゼを作用させると、還元によって活性化されたFe2+-EDTAが生成する。Fe2+-EDTAはFe型酸化酵素の活性中心と同様に、分子状酸素の活性化と基質への酸素添加の触媒として働くため、これをセスキテルペン炭化水素に作用させることで酸化的にセスキテルペノイドが生成する(図7)。
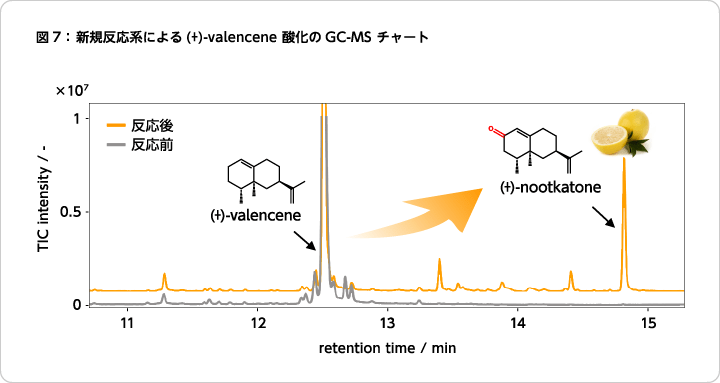
反応後のFe2+-EDTAはFe3+-EDTAに戻るが、鉄キレートレダクターゼによって再度活性化される触媒サイクルが形成されている。このように、鉄還元酵素と鉄キレート触媒を組み合わせることで、(+)-valenceneやα-guaieneといったセスキテルペン炭化水素を、(+)-nootkatoneや(−)-rotundoneといったセスキテルペノイドに変換する新たな酵素合成系を構築することができた(図8)9)。この反応形式は、酵素による還元反応と金属触媒による酸化反応が交互に繰り返されるスタイルであり、バイオと有機の複合反応として化学酵素的合成
(chemoenzymatic synthesis)とも呼ばれる。
- ●反応系のブラッシュアップ
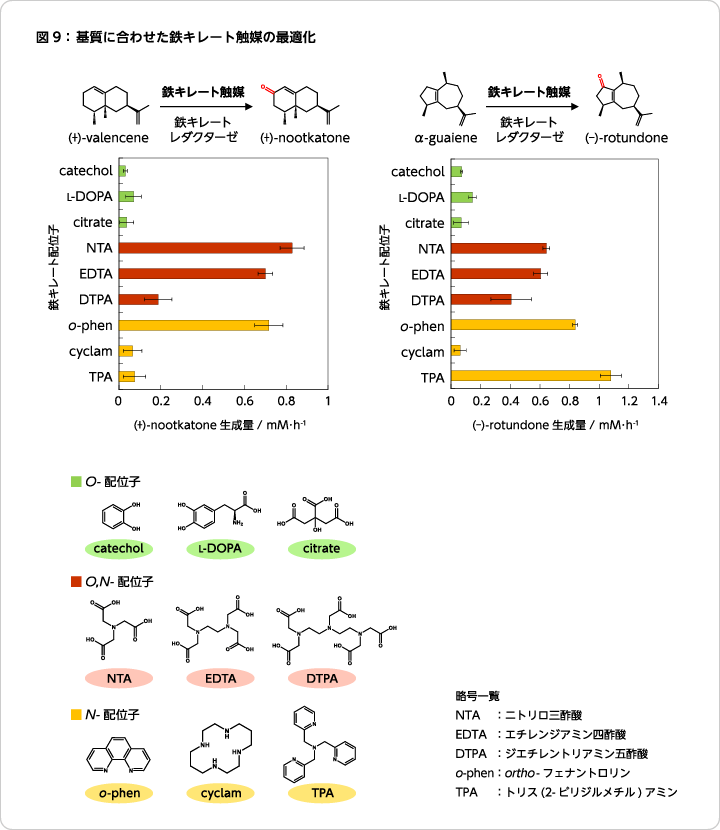
- さらに反応系の改良として、活性中心を模倣した鉄キレート触媒は「交換可能である」という特徴を利用し、鉄キレート触媒の配位子を酸化対象のセスキテルペン炭化水素に合わせて最適化することで、反応効率を向上させた。
(+)-valenceneの酸化にはFe-NTA、α-guaieneの酸化にはFe-TPAが適することがわかった。反応の肝である鉄キレート触媒を基質に合わせて変更できる点に、今回の反応系の柔軟性が示されている(図9)。加えて、反応のエネルギー源であるNADHに関しては、グルコースデヒドロゲナーゼを用いた補酵素再生系を共役させることで、反応系のNADH供給量向上とそれに伴う酸化反応速度向上が認められ、安価かつ再生可能な資源である糖をエネルギーの起点とした反応が可能となった。
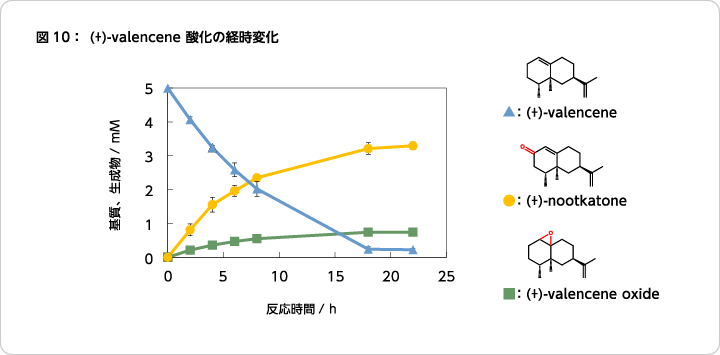
また、鉄キレート触媒による酸化反応は基質特異性の制限を回避していると同時に、酵素による保護を受けていない露出した反応であるため、副反応の抑制が課題となる。この点、セスキテルペン炭化水素を包接可能なβ-シクロデキストリンを用いることで、副反応抑制が可能であることがわかっている。このような反応系改良を経ることで、例えば(+)-valencene酸化における(+)-nootkatoneへの変換率は約70%に向上した(図10)10)。
酸化反応系の応用と今後の展開
- ●香料として有用なセスキテルペノイド合成へ
- セスキテルペン炭化水素からセスキテルペノイドを酸化的に合成する手法を探索する中で、鉄還元酵素と鉄キレート触媒を組み合わせた新しい酸化反応系を構築することができた。
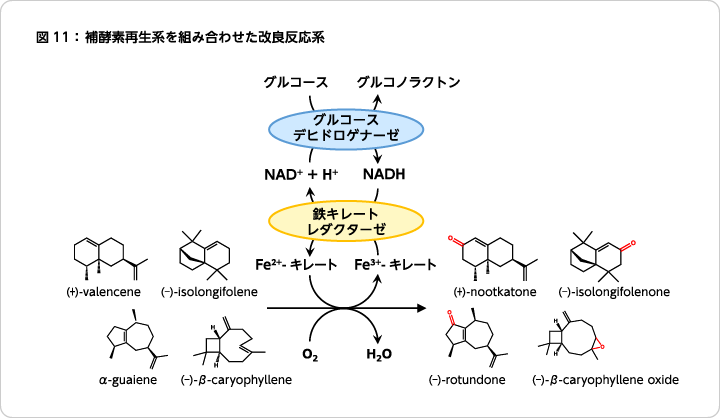
この反応系は今回紹介したセスキテルペン炭化水素以外の酸化にも展開可能であり、香料として有用なセスキテルペノイド合成に汎用的に利用することができる(図11)。さらに、今回は単離した酵素および鉄キレートのレベルで反応系を紹介したが、これを微生物の細胞内で進行させることも可能である11)。前章の鉄キレートレダクターゼの項で記したように、鉄キレート取り込みとその酵素的還元は元より微生物細胞に備わっている機能であるため、そこにセスキテルペン炭化水素を作用させることで、同様の酸化反応を進行させることができる。
- ●バイオ技術で香気化合物の製法開発に臨む
- 近年の香気分析技術の向上によって、セスキテルペノイドをはじめ、微量香気成分の発見事例が増えてきている。有用な微量香気成分を活用することで、香料としての品質を高め、優れた製品を提供できるようになるため、その工業的な需要は今後も高まっていくことが予想される。供給方法に関しては、有機合成法および酵素合成法の選択肢が存在するが、酵素合成法はまだまだ新しい手法を模索する段階にある。今後も検討を積み重ねて知見を集積することで、酵素合成法を適用できる場面は増えていくものと思われる。加えて、酵素合成法は生物が元より有する機能を活用する技術であり、SDGsの掲げる持続可能な社会の実現に貢献できる要素は多い。モノづくりを担う側の責任として、バイオ技術の最新動向とその社会貢献に通じる効果に注目しつつ、酵素や発酵を用いた香気化合物の製法開発にこれからも努めていきたい。

参考文献
- 1) Dewick, P. M. The biosynthesis of C5-C25 terpenoid compounds. Nat. Prod.
Rep. 2002, vol. 19, 181-222. - 2) Wood, C.; Siebert, T. E.; Parker, M.; Capone, D. L.; Elsey, G. M.;
Pollinitz, A. P.; Eggers, M.; Meier, M.; Vössing, T.; Widder, S.; Krammer, G.; Sefton,
M. A.; Herderich, M. J. From wine to pepper: rotundone, an obscure sesquiterpene, is a
potent spicy aroma compound. J. Agric. Food Chem 2008, vol. 56, no. 10, p. 3738-3744. - 3) 長谷川香料株式会社.柑橘香味増強剤.特許6262170. 2017-12-22.
- 4) 長谷川香料株式会社.果実香味増強剤.特許6262171. 2017-12-22.
- 5) 香料.特集号 果物の香り.日本香料協会.2014, no. 264.
- 6) Abu-Omar, M. M.; Loaiza, A.; Hontzeas, N. Reaction mechanisms of
mononuclear non-heme iron oxygenases. Chem. Rev. 2005, vol. 105,
no. 6, p.
2227-2252. - 7) Kawai, Y.; Ono, E.; Mizutani, M. Evolution and diversity of the
2-oxoglutarate-dependent dioxygenase superfamily in plants. Plant J. 2014, vol. 78, no.
2, p. 328-343. - 8) Miethke, M. Molecular strategies of microbial iron assimilation: from
high-affinity complexes to cofactor assembly systems. Metallomics. 2013, vol. 5, p.
15-28. - 9) Umezawa, S.; Konishi, S.; Kino, K. Development of a synthesis method for
odor sesquiterpenoid, (−)-rotundone, using non-heme Fe2+-chelate catalyst and ferric-chelate reductase. Biosci.
Biotechnol. Biochem. 2019, vol. 83, p. 1875-1883. - 10) Umezawa, S.; Akao, H.; Kubota, M.; Kino, K. Chemoenzymatic oxygenation
method for sesquiterpenoid synthesis based on Fe-chelate and ferric-chelate reductase.
Biosci. Biotechnol. Biochem. 2020, vol. 84, no. 4, p. 780-788. - 11) 長谷川香料株式会社.セスキテルペン酸素付加体の製造方法、化合物および組成物.再表2020-179503, 2020-9-10.
- 梅澤 覚 うめざわ さとる
-
長谷川香料(株)総合研究所技術研究所
博士(工学)。入社以来、酵素・微生物を用いた香料開発に従事。早稲田大学木野邦器教授より応用生物化学研究の指導を受ける。
見出しのみを表示する