HASEGAWA LETTER 2022年( No.40 )/ 2022.01


自然科学香話
地球存続の鍵を握る
バイオテクノロジー
-生き物たちの生存戦略に学ぶこれからの科学技術-
気候変動に見られる温暖化や新型コロナウイルス感染症拡大など地球規模で起きているさまざまな課題は、人間社会の高度化がもたらした弊害とも言える。一方、最近進展の著しい生命科学やバイオテクノロジーに対して、最先端ICTなどの情報工学やAIやロボットと高度融合した革新的な技術開発に大きな期待が寄せられている。生命の複雑にして緻密かつ柔軟な制御システムに生物の生存戦略として学ぶことは多い。脱炭素社会の実現に向けて私たちが取り組むべき技術開発研究の方向性を考えたい。
持続可能な社会に期待される科学技術開発
世界各国で気候変動をはじめとした地球環境の危機が叫ばれている中で、大気中の二酸化炭素濃度が気候に与える影響を明らかにした真鍋淑郎博士(米国プリンストン大学上席研究員)への2021年のノーベル物理学賞授与は、日本人として大変喜ばしいことである。気候変動(地球温暖化)は、私たち人間の社会活動によって排出される二酸化炭素をはじめとする温室効果ガスの増加がその原因である可能性が極めて高いと言われており、地球温暖化の鍵を解き明かして世界の動きを変えた真鍋博士らの貢献は極めて大きいものと思う。
気候変動に加え、新型コロナウイルス感染症(COVID-19)も地球規模で私たちの生活に大きな打撃を与えている。このような新興ウイルスは時として人の命も奪う厄介で迷惑なものであるが、ウイルス感染によってもたらされたウイルス由来の遺伝子が哺乳類の進化に必須であったことも最近の研究で明らかになっている。地球上のすべての生物やウイルスは同じ遺伝子システムで構成されている以上、良くも悪くも相互に関わりを持たざるを得ないが、そのお陰でCOVID-19に効果を示すmRNAワクチンも開発された。地球上の生物は私たち人間も含めて相互依存的な共生関係で進化を遂げてきた。真核生物は、好気性細菌の一種であったプロテオバクテリアを取り込み、それがミトコンドリアに変化することで強大な活動エネルギーを作り出すことができるようになり、さらに菌類や動物に進化している。光合成を行う葉緑体もシアノバクテリアの細胞内共生の結果だと言われている。これらは生物の生存戦略ともいえる進化プロセスであり、その意味で、私たちは新型コロナウイルスと今後どのように共存し、人間社会を発展させていくのかを、生物進化の観点も踏まえて考え、工夫していく必要があると思っている。
人類が直面している地球規模の多くの課題に対して、持続可能な社会の実現に向けて国連はSDGsを掲げ、地球温暖化に対しては脱炭素化社会を目指し、各国は2050年カーボンニュートラルを宣言している。生命体とも言える地球の環境保全と持続化は、人類の社会・経済活動とも強く連動しており、統合的な科学技術のイノベーション創出が解決の鍵を握っている。地球の誕生から運命を共にしてきた生命の緻密で巧妙なシステムや生物の生存戦略から学ぶことは多いと考えている。そうした観点での興味深い事例と併せ、私たちの研究の一端を紹介したい。

植物の巧みな生存戦略
人間社会が混乱していても、自然は季節を忘れずに秋になると色鮮やかな紅葉の世界を造り出している。常緑樹の木々の中に映える赤、黄、朱の鮮やかな色彩は、私たちに有無を言わさない美しさと癒やしを与えてくれている。実はこの紅葉も日照時間の少ない寒い冬を越すための植物の生存戦略でもある。植物は葉にある緑色色素のクロロフィル(葉緑素)で光合成をして栄養(デンプン)を作り出すが、日照時間の少ない秋になると生育に不利となるため、一度葉を落として幹と枝だけで冬眠状態となって春を待つ準備をはじめる。その時、光合成の必要がなくなるため葉緑素はアミノ酸に分解され、葉を落とす前に枝や幹に蓄えられる。葉の中の葉緑素が少なくなるため黄色色素のカロテノイドが優勢となり、葉は緑色から黄色に染まる。一方、葉を落とすために葉の根元と枝の間に離層が形成され、そのため枝に運ばれずに葉に残った糖分が抗酸化作用(紫外線防御作用)のある赤色色素のアントシアニンに変換される。植物にとって紅葉は生存戦略のための必要な作業であり、それが季節の移り変わりを私たちに教えてくれている。

植物は動物のように移動できない。種の保存と繁栄のために、植物は花や葉の「形状」、「色」、「香り・匂い」などを巧みに利用して、虫や鳥や動物との相互関係を構築して花粉や種子を効率的に遠くへ運ばせている。花や果実の香りは一般に昆虫や鳥類、動物を誘引し、葉のみどりの香りには抗菌活性があることで細菌やカビが原因となる感染症を抑制するなど、好まざる訪問者の攻撃に対する自己防衛効果がある。受粉をしなくても胚珠が自己増殖をして種子を作る(単為生殖をする)西洋タンポポのような植物もいて、至る所でその繁殖域を広げている。梅の花は、早春の芳香を漂わす花を枝いっぱいに咲かせて花粉を媒介する昆虫や鳥類を誘引しているが、すべての花が雌しべを持たないことで木に負担を掛けない巧妙なシステムができている。

好気性細菌が細胞内共生によって代謝系を共有するミトコンドリアに変化していった仕組みは、植物や昆虫に共生している微生物との関係においても多く観察されていて、生物の多様性を生むシステムのひとつとして興味深い。イチゴの代表的な香気成分であるフラネオールやメシフランは、メチロバクテリウムという細菌のイチゴへの共生があって初めて生合成されることや、ワインの品質や個性にブドウの植物体表面の微生物叢が大きく関わっているなど1)、生物間相互作用はそれぞれの生物の生存戦略を越えて、農産物の収量や品質など付加価値を高めることにも関係している。こうした微生物の機能や植物などとの相互作用を理解し、農業に利用することで、生活に潤いや豊かさを与えることができると考えている。
腸内細菌が、免疫やアレルギー、肥満など健康や病的状態に大きく影響していることが明らかになっている。私たち人間の体を形作っている細胞の数よりもはるかに多い約100兆匹の腸内細菌が菌叢(腸内フローラ)を形成している。最近、宿主である人間と腸内細菌との相互作用や疾病との関わりが解明されはじめており、健康管理の在り方や疾病予防、治療法の開発など、近未来の医療に大きなインパクトを与えるものと思われる。

微生物を利用したモノづくり技術
微生物と人間との関係は有史以前からで、一部は、ワインやビール、お酒や味噌・醬油、チーズやヨーグルトなど発酵品や醸造品となって私たちの食生活を豊かにしている。微生物の有する多様な機能に依存したこれら物質生産は、最初は自然界の偶然の恵みとして経験的に扱っていたが、19世紀中頃、ルイ・パスツールやロベルト・コッホなどの研究者らによって、微生物の存在とその役割が解明され、酒造りをはじめとした食品や飲料、化学品や医薬品などの製造法として、微生物やその多様な機能を担う酵素を利用したさまざまなモノづくり技術が開発されてきた。現在では、世界的な潮流となっているバイオエコノミー社会やカーボンニュートラルの実現に向けて、環境修復や資源リサイクル、バイオマス資源からのバイオ燃料の生産、ゲノム編集技術による効率的な酵素改変や品種改良、iPS細胞に代表される細胞工学による再生医療など、学術的にも新たな領域が切り開かれ、ライフサイエンスに関連する革新的なバイオテクノロジーの開発が進められており、新規産業分野も開拓されている。さらに、最先端ICT技術との高度な融合によるイノベーション創出にも大きな期待が寄せられている。

生物の生存戦略から学ぶモノづくり技術
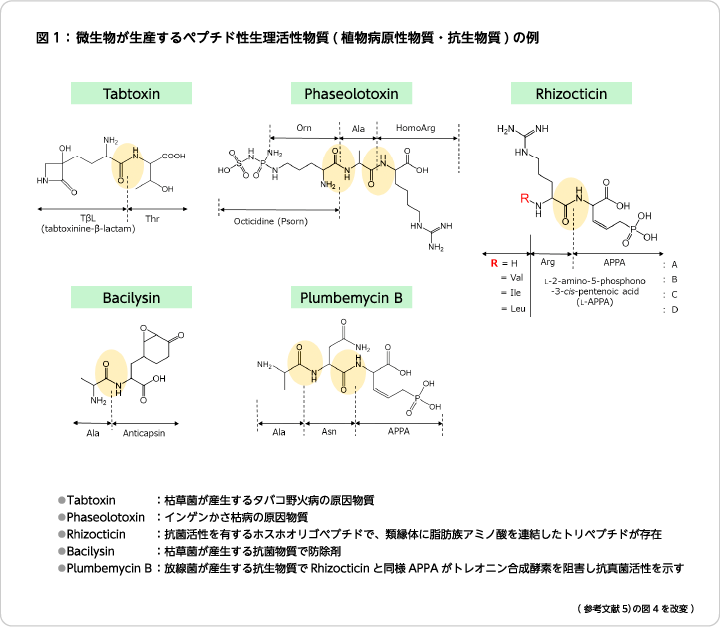
ペニシリンはアオカビが産生する抗生物質で1928年に英国のアレクサンダー・フレミングによって発見され、その抗菌活性によって感染症治療薬として多くの人の命を救った。抗生物質生産の基礎を築く研究成果であり、1945年にノーベル医学・生理学賞を受賞している。これを機に、微生物が産生する抗菌剤の発見が次々となされ創薬研究が進展した。2015年にノーベル医学・生理学賞を受賞した大村智博士による寄生虫感染症治療薬の発見をはじめ、抗腫瘍剤や免疫抑制剤、さらにはウイルス抑制剤など生理活性と構造多様性を有する化合物が数多く発見され、創薬研究や治療に広く使われている。これら化合物の中にはアミノ酸が連結したペプチド性抗生物質も存在しているが、非タンパク質性のアミノ酸であるD-アミノ酸を含むものや環状構造をしているものが多く報告されている。地球上の生物はL-アミノ酸でできているため、L-アミノ酸型ペプチドはすぐに分解されるが、D-アミノ酸を含有することで分解されにくくなり、生体内での安定性が向上する。微生物は自身の作り出すペプチドが分解されず安定に活性を発現することで他の微生物を排除し、自身の棲息領域を広げる生存戦略をとっている。
筆者らは、微生物機能を活用した有用物質の効率的生産プロセスの開発研究を行っているが、無保護のアミノ酸を原料として任意のペプチドを直接生産する酵素合成法をいくつか開発している。砂糖の約200倍の甘味を有するアスパルテーム(L-アスパラギン酸とL-フェニルアラニンメチルエステルが連結したジペプチド)でもわかるように、ペプチドになることでそれを構成するアミノ酸単独にはない物理化学的特性や生理活性を発現するため、機能性健康食品をはじめ医薬品や化成品など幅広い分野での利用展開が期待されている。とくに最近では抗体医薬に代わる中分子医薬品としての需要が拡大しており、新たな活性の発現を期待してD-アミノ酸や非天然アミノ酸を含有する特殊構造ペプチドの創製とそれらの簡便な合成法の開発が求められている。以下に、筆者らのペプチド合成研究の概要を紹介する。

(1)L-アミノ酸リガーゼによるペプチド合成
無保護の遊離D-アラニンをATP依存的に連結してD-アラニン-D-アラニン(D-Ala-D-Ala)を合成する酵素としてD-Ala-D-Alaリガーゼ(Ddl)が知られている。同じ反応機構によって遊離のL-アミノ酸を連結するジペプチド合成酵素L-アミノ酸リガーゼ(Lal)が田畑らによって初めて見出され、培地成分として需要のあるL-アラニル-L-グルタミンの工業生産プロセスの開発につながっている2)。この酵素の発見は、微生物のD-アラニンを含む細胞壁構造に広く知られる生存戦略からヒントを得たものである。
筆者らもペプチドの機能性や有用性に期待して新規Lalの探索と簡便な合成法の開発を目指した。田畑らと同じように微生物のゲノム情報を活用する方法に加えて、構造多様性を有する既知のペプチド性抗生物質にも着目して(図1)、それらを産生する微生物からLalの探索を行ったところ、新たな基質特異性を有するLalの発見はもとより、ジペプチドのみならず最大8アミノ酸が連結したオリゴペプチドの合成を可能とする初めてのLalなどを数多く見出すことに成功した3)。また、これらLalの結晶構造を明らかにして構造との機能相関を解析することで反応活性の向上した酵素を創り出すこともできるようになっている。これまでに、血管を弛緩させることで降圧作用を示すジペプチドや、塩味増強効果を有するジペプチドの発見および効率的生産法の開発4)、抗酸化作用や抗炎症作用、脳機能改善効果など高齢化社会におけるフレイル予防が期待されているイミダゾールジペプチドの生産プロセス開発などにも成功している。イミダゾールジペプチドの一種であるカルノシン(β-Ala-L-ヒスチジン)の生産では原料アミノ酸に対してほぼ100%となる高い変換率を達成している。さらにペプチドの分解を抑制しつつ高価なATPの外部添加を必要としない菌体反応系による低コストプロセスの開発にも成功している5)。
現在では、これまでに発見した約20種類のLalを利用することで、非タンパク質性アミノ酸をはじめとする非天然型アミノ酸ならびにそれらの誘導体を含む任意の有用ペプチドの生産が可能になっている。このように、本来微生物の生存戦略として備えていたペプチド性抗生物質の生合成系に着目することで、ペプチド結合形成反応を担う新たな酵素を見出すことができた。
(2)アデニル化酵素を利用したペプチド合成
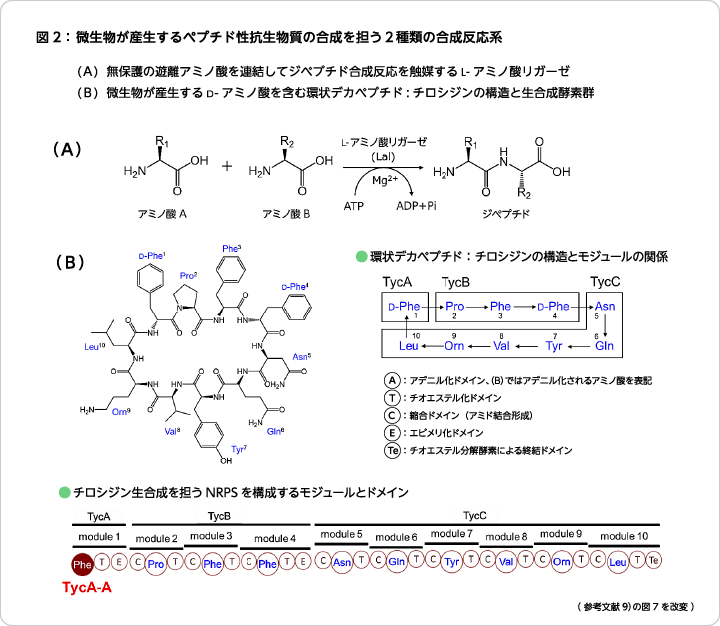
放線菌などが産生するD-アミノ酸を含むペプチドには、非リボソームペプチド合成酵素(non-ribosomal peptide synthetase:NRPS)という巨大な酵素複合体の特殊な反応様式によってシステマティックに合成されているものが多くある(図2)。このペプチド合成には、反応に必要な4つのドメインが一つの基質アミノ酸に対してセットされていてモジュールを形成している。①アデニル化によって基質アミノ酸を活性化するAドメイン、②活性化アミノ酸をチオール化して次の縮合反応に備えるためのTドメイン、③基質アミノ酸のD/L変換(異性化)を担うEドメイン、④次のアミノ酸を連結(縮合)するCドメイン、がそれぞれの役割と相互連携によって、特有のアミノ酸配列を有するペプチドが精密かつ整然と合成されている6)。基質アミノ酸の認識機構解明や基質特異性改変に関する研究は盛んに行われているが、筆者らはこれまでの自身のペプチド合成研究の過程で得られた知見を踏まえて新たなペプチド合成法を発想し、キラリティ制御が可能な自由度の高い革新的な合成プロセスの開発に成功している。
ペプチドを酵素合成するためのアミド結合形成反応は、ATPの加水分解によって発生するエネルギーを駆動力として、基質アミノ酸のカルボキシ基の活性化とそれに続くもう一方の基質となるアミノ酸のアミノ基による求核置換によって成立する。研究を進めている過程で、求核攻撃する基質アミノ酸の特異性が一般的に甘いことを見出し、アミノ酸が活性化されれば、酵素が介在する疎水的な環境下では求核剤の種類に関係なくアミド結合形成反応が進行してペプチドが合成されると考えた。その仮説を検証するために、NRPSのシステムからアデニル化を担うAドメインだけを切り出して、単一酵素として機能するように調製して検討を行った。予想通り、縮合ドメインが存在しなくてもアミド結合形成反応は進行し、配列順序の決まった目的のジペプチドが生成した。求核置換反応が酵素に依存しない化学反応であるため、求核剤はアミノ酸に限定せず、求核活性を有する多様なアミンが利用可能で、また、アミノ酸もそのキラリティに関係なく、L-アミノ酸もD-アミノ酸も、またそれらの各種誘導体も連結させることが可能で、ジペプチドをはじめ多様なアミド化合物を合成することができるようになった(図3)。このように、酵素反応と化学反応を連携させたユニークなアミド結合形成反応(chemoenzymatic amide bond formation reaction)は学術的にも工業的にも意義のある拡張性の高い合成法であり、医薬品や機能性化成品の原料供給などに貢献するものと考えている7)。
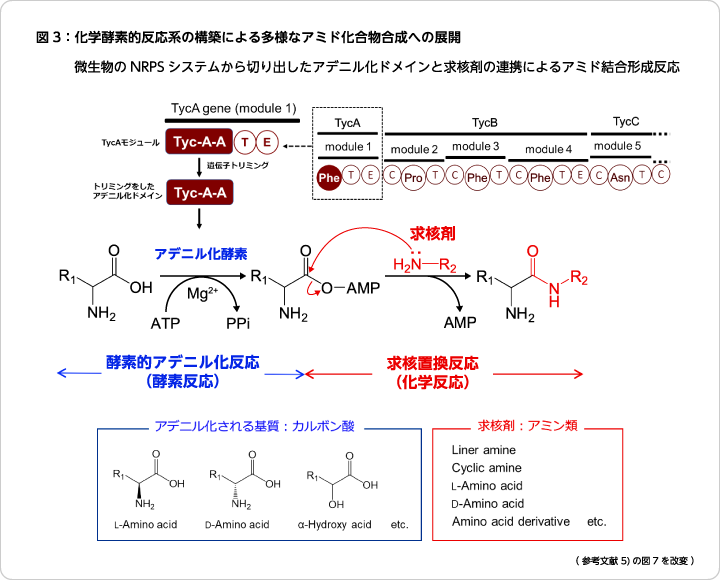
(3) キラリティ制御が可能なジペプチド合成
上記研究の試料とした環状デカペプチドであるチロシジン(tyrocidine)の合成を担うNRPSのAドメイン(TycA-A)は、興味深いことに生理基質であるL-フェニルアラニン(L-Phe)だけでなく、L-トリプトファン、L-チロシン、L-バリン、L-ロイシン、L-イソロイシン、L-メチオニン、L-アラニンも、またその鏡像異性体であるD-アミノ酸も同じように基質として認識し、カルボキシ基をアデニル化する。上述したように、新たに開発したペプチド合成法ではC末端に任意のD-, L-アミノ酸を導入可能であるため、N末端アミノ酸のアデニル化触媒にTycA-Aを利用することで、D-, L-アミノ酸を含むジペプチドのデザインと合成におけるキラリティ制御が可能となった8)。
NRPSの緻密で規則正しいペプチド生合成システムの中に、このように曖昧な基質認識をするAドメインが存在していることに大きな驚きと興味を持った筆者はある推測をした。すなわち、基質アミノ酸を異性化も含めた一連の反応によってペプチドは整然と合成されているが、仮に最初のアデニル化段階でアミノ酸認識やそのキラリティ(D-, L-体)認識が甘くても、その後に控えている異性化反応を触媒するエピメル化ドメイン(Eドメイン)や基質アミノ酸とそのキラリティを認識して2つのアミノ酸を連結する縮合ドメイン(Cドメイン)があれば、微生物菌体内における生合成では生理基質以外のものは排除され、全く問題なくチロシジン合成が完結するだろうと考えた。事実、NRPS内でTycA-Aのようなドメイン構成をしているAドメインを検証したところ、D-, L-アミノ酸の両方を基質とするアデニル化ドメインを効率よく探索することができた。自然界にはNRPS以外にもカルボキシ基をアデニル化する酵素は多く存在する。筆者らは、そのような活性ドメインにも着目して、多様なアミド化合物合成を可能とする新たな合成法を開発した9)。
本研究から、微生物酵素の基質やキラリティの認識に関わる曖昧さがある一方で、キラリティを厳密に制御するシステムと機能拡張の柔軟性を兼ね備えていることを見出した。生命の巧みな生存戦略の一端を垣間見たように思う。

生物の生命システムと化学反応から学ぶ新たな合成法の開発
生合成システムからその鍵となるタンパク質(活性ドメイン)を解放して反応系をデザインすると、上述のようなユニークなアミド結合形成反応や化学反応と連携させた革新的な化学酵素的反応システムを創成することができる。こうした考え方を生物の基本となる重要な反応システムに展開させることで、さらに、その有用性を拡張し、反応システムを進化させることができると考えている。以下に、その研究事例を簡単に紹介する。
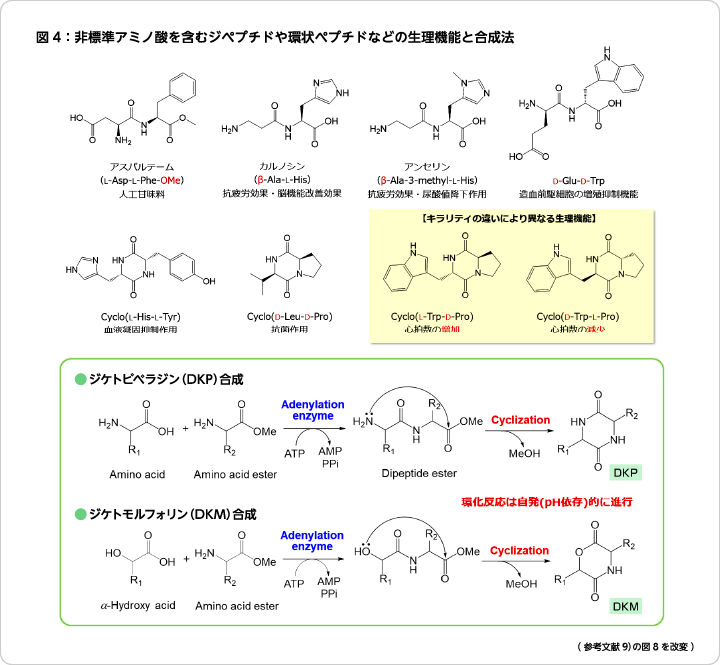
キラリティを制御したD-, L-アミノ酸を含有する任意のジペプチドの合成が可能となったため、求核剤としてアミノ酸エステルを用いると、生成するジペプチドエステルはpH依存的に自発環化し、最小の環状ペプチドであるジケトピペラジン(DKP)を合成することができる。同じようにヒドロキシ酸とアミノ酸エステルから、環状デプシペプチドであるジケトモルフォリン(DKM)を合成する方法も開発した9)。これらの反応系は、アデニル酵素による化学酵素的アミド結合形成反応と分子内環化反応を連携させたもので、これまで有効な合成法がなかったDKPやDKMの効率的なワンポット合成を可能とし、その反応システムの特性から多様な立体構造を有する環状ペプチドを創製することができるようになった(図4)。DKP及びDKMはその分子構造特性から多彩な生理活性を発現し、医薬品や創薬原料として最近注目されている。ポリマー原料としての利用や、プロリン誘導体を中心とした触媒活性を有する機能性ペプチドの創出によって2021年度のノーベル化学賞となった「不斉有機触媒」をさらに大きく展開するなど、その可能性は大きい。
筆者らは、化学酵素的合成法を酸化反応による有用化合物の合成にも適用し、香料として有用なセスキテルペノイドの合成法の開発に成功した。セスキテルペンの酸化による合成方法を探索する中で、細胞内金属イオンであるFe2+が触媒として分子状酸素を活性化し、セスキテルペノイドの合成が可能であることを見出した。非ヘム型Fe2+-キレート触媒を用いたアリル位酸化が報告されていることから、生体内でFe2+-キレート生成を担う鉄キレート還元酵素と組み合わせることで、Fe2+-キレートによる持続的な酸化活性を実現することができ、その結果、多様なセスキテルペノイドの効率的な合成が可能となった(詳細はHASEGAWA LETTER No.40 「バイオ技術を用いたセスキテルペノイド合成法~鉄還元酵素と鉄キレート触媒の組み合わせによる新規合成法~」参照)10)。
脱炭素社会の実現 それは人類の、そして地球の生存戦略
2021年度のノーベル賞として、気候変動モデルの構築に対する物理学賞と精密な化学反応を安価に行える不斉有機触媒の分野を切り拓いた業績に対する化学賞に触れたが、医学・生理学賞は温度と触覚を感知する受容体を発見した業績が対象となった。触覚(皮膚感覚)は、味覚、嗅覚、視覚、聴覚と併せ、人間など多くの生物が備えている五感と呼ばれる重要なセンサー機能(感覚)の一つであるが、2021年度のノーベル賞はいずれも現在話題となっている専門分野の研究成果に対してであり、世界に向けた効果的なメッセージになったと思う。
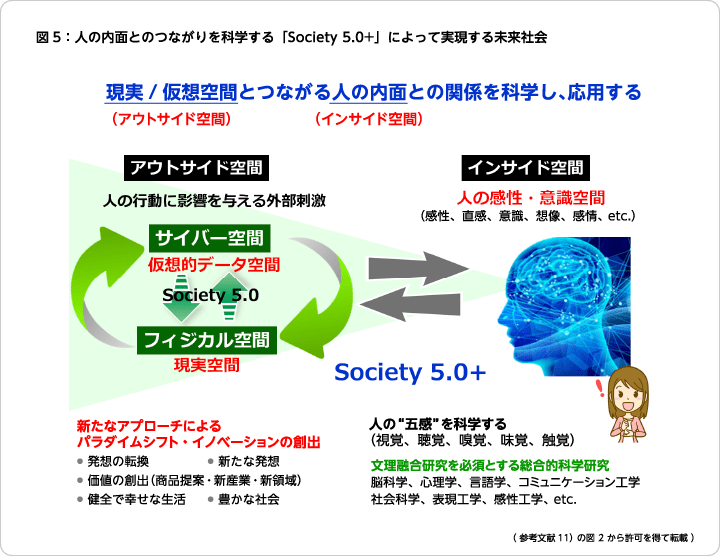
国連が掲げているSDGsに対する具体的なアクションプランとして我が国はSociety 5.0を第5期科学技術基本計画の中で示し、2021年に新たに策定された第6期科学技術・イノベーション基本計画ではSociety 5.0の実現を目指している。Society 5.0は、近年急速に進展したICTなどの情報技術やAI・ロボットでの技術革新と生命科学やバイオテクノロジーにおける著しい技術開発などを背景として、仮想空間と現実空間を高度に融合させたシステムの構築により、経済発展と社会的課題解決の両立を可能とする理想的な人間中心の未来社会を指しており、これにカーボンニュートラルの達成による脱炭素化や新型コロナウイルスのような感染症への対応を盛り込んだ持続可能な社会の実現を目指している。筆者は、「人間中心」という点において、一人一人の個人レベルで豊かさや幸せを感じる技術開発をもっと前面に押し出すことが重要だと考えて、人間の内面を融合させた新たな理想社会「Society 5.0+」の実現を提唱している(図 5)11)。すなわち、現実と仮想空間につながる人間の内面(感性、感情、精神活動など)との関わりを意識した研究が重要だと考えている。そのためには、脳科学や生命科学などの理工系分野と社会科学や人文科学といった文系分野との融合が不可欠となる。人間はさまざまな場面で五感を介して周囲の状況を感じて感情や情動が生まれ、それが多様な価値判断や行動につながっていくものと思う。こうした人間の生物としての複雑で緻密な固有の反応に寄り添った研究が今後重要になると考えている。
生命誕生からはじまり、生命は多様な生物へ進化し、それぞれの生存戦略の中で地球生物ファミリーは繁栄してきた。今、その頂点に立つ人間は科学技術を武器に社会・経済活動を繰り広げて豊かな近代社会を構築してきたが、一方で、さまざまな問題を地球規模で引き起こしてきた。SDGsの実践と実現への取り組みや、地球温暖化対策として掲げられたカーボンニュートラルや脱炭素化社会への取り組みは、「人間社会の、人類の、さらには地球の生存戦略」であると言える。私たちはこの危機を真摯に受け止め、これまでに蓄積してきた多様な知と新たなイノベーションを総合的な知として生かし、覚悟を持って取り組むことが重要だと考える。今後、人類は、生命の仕組みや生存戦略の学びから知恵と勇気と覚悟をもって革新的技術の開発研究を推進し、人間の感性などとつながった人に寄り添った新たな技術の開発によって危機を乗り越え、この美しい地球を次の世代にしっかりと送り届ける使命を果たしていかなければならないと思う。

参考文献
- 1)国立研究開発法人科学技術振興機構 研究戦略センター編.植物と微生物叢の相互作用の研究開発戦略 ―理解の深化から農業/物質生産への展開―.2017,
CRDS-FY2016-SP-01.https://www.jst.go.jp/crds/pdf/2016/SP/CRDS-FY2016-SP-01.pdf - 2)田畑和彦.ジペプチド発酵技術の開発と工業化.化学と生物.2015, vol. 53, no. 8, p. 547-552.
- 3)木野邦器.オリゴペプチド合成を触媒する新規アミノ酸リガーゼ.薬学雑誌.2010, vol. 130, no. 11, p. 1463-1469.
- 4)木野邦器,木野はるか.L-アミノ酸リガーゼを利用した塩味増強効果を発揮するジペプチドの探索とその効率的な合成法:ユニークな酵素で拡がる機能性ジペプチドの世界.化学と生物.2017,
vol. 55, no. 3, p. 182-188. - 5)木野邦器,有用微生物酵素の探索とバイオプロセス開発への応用研究.生物工学会誌.2021, vol. 99, no. 1, p. 2-14.
- 6)鷲尾健司,森川正章.mRNAを鋳型としないペプチド合成反応:セントラルドグマを凌ぐ微生物の営みに学ぶこと.化学と生物.2006, vol. 44,
no. 2, p. 85-92. - 7)Hara, R.; Hirai, K.; Suzuki, S.; Kino, K. A chemoenzymatic process for
amide bond formation by an adenylating enzyme-mediated mechanism. Sci. Rep. 2018,
8:2950. DOI: 10.1038/s41598-018-21408-8 - 8)Kano, S.; Suzuki, S.; Hara, R.; Kino, K. Synthesis of D-amino acid-containing dipeptides using the adenylation
domains of nonribosomal peptide synthetase. Appl. Environ. Microbiol. 2019, vol. 85, no.
13, e00120-19. - 9)木野邦器,鈴木伸,原良太郎.アミノ酸リガーゼやアデニル化酵素を利用したジペプチドの合成.生化学会誌.2021, vol. 93, no.3, p.
338-348. - 10)Umezawa, S.; Akao, H.; Kubota, M.; Kino, K. Chemoenzymatic oxygenation
method for sesquiterpenoid synthesis based on Fe-chelate and ferric-chelate reductase.
Biosci. Biotechnol. Biochem. 2020, vol. 84, no. 4, p. 780-788. - 11)荒勝俊,木野邦器.早稲田地球再生塾が目指す“Society 5.0+”の世界.生物工学会誌.2018, vol. 96, no. 12, p.
720-721.
- 木野 邦器 きの くにき
-
1981年早稲田大学大学院理工学研究科応用化学専攻修了後、同年協和発酵工業㈱に入社。アミノ酸、核酸、抗生物質、ビタミンなど各種生理活性物質の発酵生産などの生産菌株の育種や製造プロセスの開発研究に従事。1987年工学博士(早稲田大学)。1999年早稲田大学理工学部(現 理工学術院)教授、2014年理工学術院総合研究所所長兼務、現在に至る。科学技術振興機構研究開発戦略センターシニアフェロー、かずさDNA研究所特別客員研究員を兼務、日本生物工学会会長などを歴任。専門は応用生物化学(生物機能利用工学)。
2016年文部科学大臣表彰科学技術賞受賞、2020年日本生物工学会生物工学賞受賞。

見出しのみを表示する