HASEGAWA LETTER 2025年( No.43 )/ 2025.01


自然科学香話
嗅覚受容体とそれを用いた
匂いセンサーの開発
~国際交流で発展した嗅覚研究の成果~
人間の五感である視覚、聴覚、味覚、嗅覚、触覚は、古くから人々の関心の対象であり、多くの研究が行われてきました。味覚以外の感覚に関する研究はいずれもノーベル賞の受賞対象となっています。五感に代わる様々な人工的なセンサーが開発されていますが、麻薬探査などで犬が活躍しているように、動物の嗅覚より優れた化学センサーは存在しません。私は、偶然、この嗅覚のメカニズムとそれを用いたセンサーの開発に取り組むことになりました。ここでは、この研究の経緯とその成果について紹介させていただきます。
嗅覚研究 はじめの一歩
私の所属する東京農工大学大学院工学府生命工学専攻では、夏休み期間中に大学院セミナーというイベントがあります。正式な名称は、生命工学特別研究であり、博士前期課程の必修科目です。学生は、最先端の英文の研究論文を数報読み、そのレビューを執筆した上で、発表して質疑を受けます。約20年前の2005年に、研究室の修士1年の女子学生からテーマに関する相談を受け、2004年にノーベル生理学・医学賞を受賞したRichard Axel博士とLinda Buck博士の「匂い受容体遺伝子の発見」に関する論文を勧めました。彼女は真面目に様々な論文を読み、レビューをまとめて発表しました。これが、私と嗅覚研究の最初の出会いです。
学生が大学院セミナーで嗅覚に関するレビューを発表した翌年に、機械工学専攻の先生方から匂いセンサーの開発に関する共同研究の提案があり、学生が大学院セミナーでまとめたレビューで勉強した嗅覚受容体を用いたセンサーの開発を提案したことから、嗅覚に関する研究がスタートしました。
嗅覚受容体とは
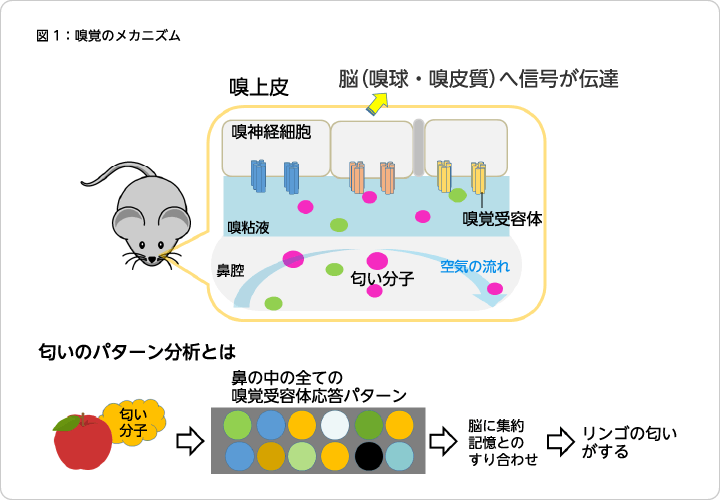
鼻腔に入った匂い分子は、嗅上皮と呼ばれる部位に届き、そのなかの嗅細胞の先端の嗅繊毛の膜に存在する嗅覚受容体に結合し、その結果匂いという化学信号が電気信号に変えられ、嗅球を通って大脳へ情報が伝えられます。Axel博士とBuck博士の業績は、嗅覚受容体の正体を明らかにしたことです1)。彼らが発見した嗅覚受容体は、Gタンパク質共役型受容体(GPCR)と呼ばれるタンパク質でした。GPCRは細胞の表面に存在し、リガンドの結合のシグナルを細胞内に伝達するセンサーの役割を担っています。ヒトのゲノムには多数のGPCRの遺伝子が存在し、様々な機能を担っています。GPCRは、米国食品医薬品局(FDA)承認薬の標的であるタンパク質の30%以上を占めており、創薬標的として極めて重要な膜タンパク質ファミリーです。2006年にGPCRの1つであるアドレナリン受容体の構造を解明した Brian K. Kobilka 博士が2012年にノーベル化学賞を受賞したことで、その重要性が明らかだと思います。
ヒトには800種類のGPCRが存在しますが、驚くべきことに、嗅覚受容体はその半分の約400種を占めています。優れた嗅覚を有しているイヌでは800種類程度の嗅覚受容体があります。マウスやラットでは1000種類以上、象には2000種類以上もの嗅覚受容体があります2)。一方、水生哺乳類であるイルカには機能的な嗅覚受容体遺伝子が存在しないことが知られています。水中生活に適応する過程で、嗅覚を完全に失ってしまったと考えられています。イルカの鼻は頭頂部にありますが、それは呼吸孔としての役割しか持ちません。それに対して、魚類は優れた嗅覚を持っていますが、受容体の種類はたかだか数十個です。実は、ヒトのゲノムには約900の嗅覚受容体遺伝子が存在しますが、その過半数は機能を失った偽遺伝子です。ヒトは他の哺乳類と比較して嗅覚に依存しなくなっているので、進化(実は退化ですが)の過程で、多く嗅覚受容体が不要となり、偽遺伝子になったと考えられます。
ヒトなどが嗅覚で検知する匂い分子の種類は10万種類以上あると言われています。数百種から2千種類の嗅覚受容体で、これだけの匂い分子を検出、識別するために、1つの受容体が複数の匂い分子を認識します。同時に、1つの匂い分子は複数の受容体と結合します。我々は複数の嗅覚受容体の応答のパターンから匂いを認識、識別することになります。その結果、複数の匂い分子が同時に存在すると、異なるパターンになり、違った匂いとして感じることになると言われています3)(図1)。

松波宏明先生との出会いとRTP
さて、私の研究室では、嗅覚受容体を酵母で発現させ、匂いを感じる酵母の開発を試みていました。しかし、嗅覚受容体の酵母での機能発現性は乏しく、応答が不安定で感度も低いことから、嗅覚センサー開発の研究を断念しようと考えていました。2011年に博士課程の学生を海外に派遣する制度がスタートし、当時研究室で嗅覚受容体の研究を行っていた福谷洋介さん(現東京農工大学助教)の派遣先を考えていました。いろいろ調査したところ、アメリカDUKE大学の松波宏明先生の研究室が良いのではないかと考え、メールを出したところ、快く引き受けていただきました。
松波先生は、Buck先生の研究室で博士研究員をされた後、DUKE大学で研究室を主宰されている嗅覚研究の第一人者です。松波先生の研究に興味を持ったのは、Receptor Transporting Protein(RTP)と呼ばれる分子を発見されたからです4)。Buck先生たちの発見以来、それぞれの嗅覚受容体のリガンドを特定する試みが進められましたが、ほとんど成功していませんでした。その原因は、嗅覚受容体を培養細胞で機能的に発現することが困難だったからです。多くの嗅覚受容体が、発現しても細胞膜表面に到達することなく、細胞内に留まっていました。動物細胞でも困難なので、酵母で機能的発現が困難なのは当然のことでした。松波先生は、嗅細胞で発現するタンパク質の中から、嗅覚受容体の機能的発現をサポートするタンパク質を発見し、RTPと命名しました。RTPの発見により、嗅覚受容体の研究が大きく進みました。嗅覚受容体とRTPを同時に細胞で発現することで、多くの嗅覚受容体が機能を有した状態で発現し、そのリガンドの同定が可能となっています。
生物の設計図であるゲノムのDNAの配列情報は、mRNAに転写され、その配列情報からタンパク質が翻訳合成されます。すなわち、DNAの塩基配列をもとに、タンパク質のアミノ酸配列が決定されます。タンパク質は合成された時は、アミノ酸の直鎖状のポリマーですが、その配列に基づいて立体構造を形成し機能を発現します。多くのタンパク質は、自発的に構造を形成することが知られています。しかし、一部のタンパク質は自発的に構造形成ができず、他のタンパク質によるサポートを必要とします。そのサポートするタンパク質は分子シャペロンと呼ばれています。
分子シャペロンは、細胞内のタンパク質の構造形成や機能維持などで重要な役割を担っています。例えば、タンパク質は高温で処理すると立体構造が破壊され、機能を失います。これをタンパク質の変性と言います。タンパク質が変性すると、機能を失うだけでなく、細胞の機能を阻害することがあります。例えば、アルツハイマー病はタンパク質の変性により脳細胞が障害を受けることで、発症します。分子シャペロンはタンパク質の変性を防ぎ、その影響を抑制する機能を有しています。シャペロンの語源は、フランス語の中世ヨーロッパで頭部に着用した布や帽子を意味する用語でした。19世紀末から20世紀初頭のイギリスにおいて、家事使用人の上級職の1つを指すようになり、その仕事内容は「若い未婚の女性が社交界にデビューするときに社交の礼儀作法を指導する」というものでした。ここから転じて分子シャペロンという用語が誕生しています。松波先生の発見したRTPは嗅覚受容体の分子シャペロンであると考えられています。私自身が、分子シャペロンの構造や機能に関する研究を長く行っていたことから、松波先生の研究に関心を持ち、共同研究を提案しました。その共同研究は、福谷さんが留学した2011年から10年以上続いており、多くの学生が松波先生の研究室に留学して、様々な成果を出しています。
嗅覚受容体の構造安定性とRTPの役割
RTP遺伝子を欠損させると、大多数の嗅覚受容体が細胞膜に発現できず、嗅覚応答が低下しますが、一部の嗅覚受容体は細胞膜局在を保つため嗅覚を完全に失われません5)。福谷さんに続いてDUKE大学に留学した池上健太郎さんは、約200種のマウス嗅覚受容体に対してRTPがない条件でヒト由来培養細胞の細胞膜に発現するか調べました。すると、一部の嗅覚受容体は単独で細胞膜に発現し、機能することを明らかにしました。これらの嗅覚受容体の分子シミュレーション解析により、単独で細胞膜に発現できる嗅覚受容体は他の嗅覚受容体に比べ、タンパク質の立体構造形成が安定であることが示されました。
次に、ヒト嗅覚受容体のアミノ酸配列から分けられるグループごとに、アミノ酸配列の共通性の高いコンセンサス嗅覚受容体を人工的に構築し、細胞でその機能を評価しました。すると、一部のコンセンサス嗅覚受容体は非常に高い細胞膜局在を示し、匂い分子応答性を示しました。コンセンサス嗅覚受容体に対し、分子シミュレーション解析から熱安定性を高めると予測されたアミノ酸変異を導入したところ、匂い分子応答性を保持したまま細胞膜発現量が増大しました6)。タンパク質の熱安定性と機能的発現量に相関を示すことはある程度予想できることですが、嗅覚受容体ではたった1つのアミノ酸変異であっても、その機能性を大きく変化させます。嗅覚受容体は非常に種類が多く、それは環境中の多彩な匂いに対応するために遺伝子変異の速度が速くなったと考えられています。アミノ酸に変異が起きることで、受容体が応答できる匂い分子が増える一方で、その代償としてタンパク質の構造安定性が低下してしまったと考えられます。しかし、生物はこの不安定な嗅覚受容体も機能させるために、RTPという分子シャペロンを生み出し、多様な嗅覚受容体を機能させ、嗅覚を発達させるように進化を遂げていったと考えられます。
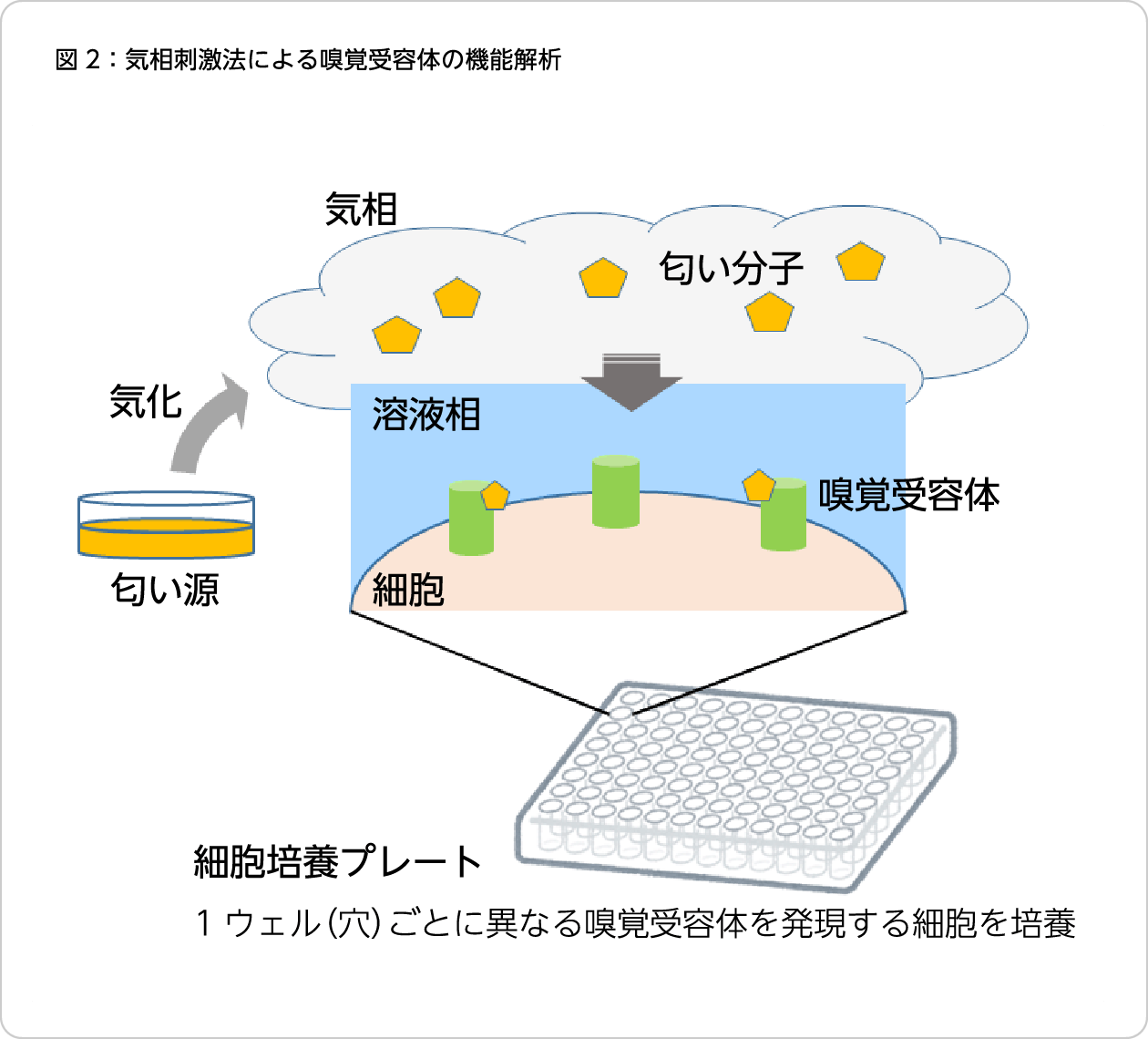
気相刺激法による嗅覚受容体の
機能解析
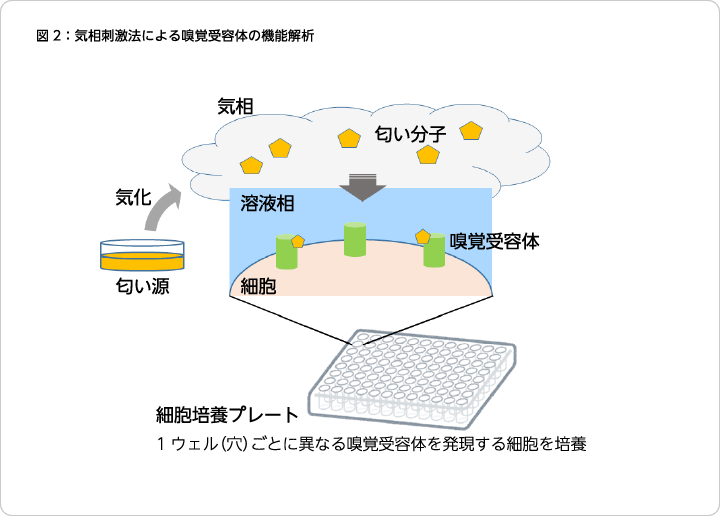
機械工学専攻の学生だった木田仁さんと福谷さんは、マウスの嗅覚受容体発現細胞を利用した高識別な匂い分子検出手法を開発しました7)。嗅覚受容体の匂い分子への応答解析では、試験する匂い分子を溶媒に溶かし、嗅覚受容体発現細胞を直接刺激する手法が取られていました。一方、実際の生物の鼻では、大気中の匂い分子は嗅細胞を覆う嗅粘液に溶け込む過程を経て、嗅覚受容体と反応します。この気相中の匂い分子の溶け込みを模倣して、複数の嗅覚受容体の応答を同時にモニタリングするという、より本来の嗅覚に近い手法での解析はこれまで実施されていませんでした。気相中の匂い分子に対する応答を、嗅覚受容体が反応すると細胞内で発光を示すように設計したルシフェラーゼの発光を指標に検出を試みたところ、気相中の匂い分子に対して応答した細胞の発光を検出することに成功しました(図2)。気相から匂い分子にさらされた際の複数の匂い受容体の応答パターンを一度に解析することで、化学構造の非常に近い匂い分子の識別に成功しました。さらに、本手法を用いることで、嗅粘液中に含まれる代謝酵素が特定の匂い分子-嗅覚受容体の組み合わせの反応を大きく変化させることを明らかにしました。
アンタゴニストによる匂い応答の抑制
福谷さんたちは、その気相刺激法を応用することで、常温気体の揮発性硫黄化合物であるメタンチオール(別名メチルメルカプタン)と硫化水素に応答するヒト嗅覚受容体の探索を行いました。その結果、OR2T11など3種の嗅覚受容体を同定しました。次に、100種の実用可能な香料の中から、スミレの花のような香りを感じるβ-イオノンを含む香料が嗅覚受容体のメタンチオール応答を顕著に抑制することを発見しました。これらの抑制作用を示 した香料は同定した3つの嗅覚受容体すべてにおいてメタンチオールや硫化水素に対する応答を抑制しました。OR2T11の3次元構造モデルを使ったコンピューターシミュレーション解析により、OR2T11の匂い分子結合ポケットに、メタンチオールとβ-イオノンの両方とも入り込むことが予測されました。この結果から、β-イオノンがOR2T11のアンタゴニストとして作用することで、メタンチオール応答が抑制されることが分かりました。
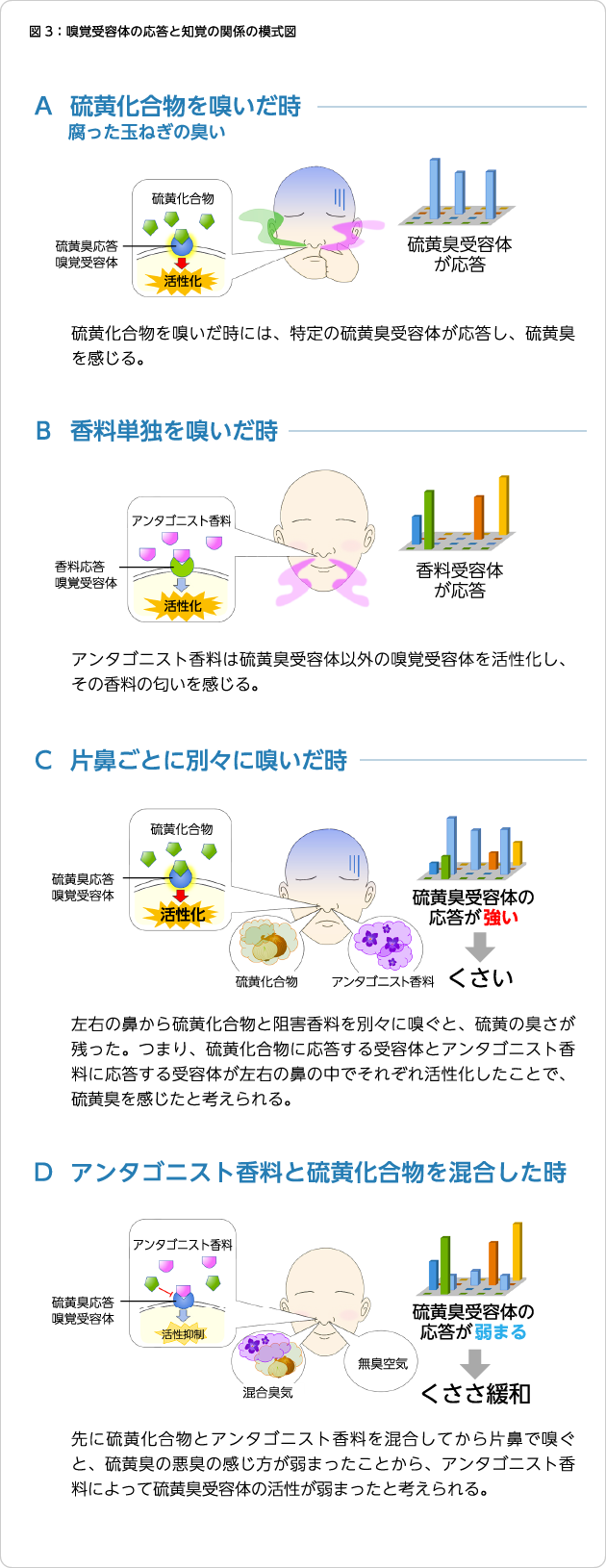
次にアンタゴニストであるβ-イオノンが、メタンチオールの悪臭の感じ方を抑える効果があるかどうか官能評価試験を行って検証しました。抑制作用があるβ-イオノンと応答抑制効果をもたない香料(Iso E super)を比較すると、β-イオノンの方がメタンチオールの臭気強度を有意に抑制しました。この抑制作用はβ-イオノン自体の匂いの感じ方と相関はなく、β-イオノンの匂いを感じにくい人でも硫黄臭抑制作用が見られたことから、β-イオノンの香りによるマスキング作用ではないと考えられました。そこで、左右の鼻の穴から異なる気体を吸引し、知覚の変化があるか確かめました(図3)。メタンチオールとβ-イオノンをそれぞれ別々の鼻の穴から吸引した場合、β-イオノンによるメタンチオールの悪臭の感じ方は抑えられませんでした。メタンチオールとβ-イオノンを予め混合した混合ガスを片方の鼻の穴から吸ったときは硫黄臭の感じ方を抑制しました。この片鼻刺激の官能評価の結果は、ヒトの匂い知覚が脳の高次領域で起きる拮抗作用ではなく、末端である鼻の嗅覚受容体の匂い分子応答の活性化パターンの組み合わせが重要であることを示しています。嗅覚受容体ごとに異なる匂い分子選択性に加えて、拮抗的な相互作用を示すアンタゴニスト香料による嗅覚受容体の機能抑制がヒトの匂いの知覚を変えることを世界で初めて実証しました8)。

嗅覚受容体を用いたセンサーの開発
さて、当初の目的だったセンサーの開発はどうだったでしょうか。RTPを用いたとしても、細胞での嗅覚受容体の発現量は限られているので、細胞で発現する嗅覚受容体をセンサー開発に利用することは困難だと考えました。また、遺伝子組み換えで一般的に用いられる大腸菌でも発現量が少なく、精製の手間を考えると適切ではありません。そこで着目したのが、無細胞タンパク質合成系です。大腸菌や細胞のタンパク質合成に様々な必要な因子と目的タンパク質のmRNAを組み合わせることで、人工的にタンパク質を合成することが可能です。合成量は少ないですが、他のタンパク質がほとんどないので、精製をする必要はないです。無細胞タンパク質合成系は大腸菌由来の因子を用いたものと、小麦胚芽由来のものを用いたものがあります。嗅覚受容体は、動物細胞由来の膜タンパク質であることから、同じ真核生物である小麦の胚芽由来のシステムが適切だと考えました。実際に、小麦胚芽由来無細胞タンパク質合成系を用いることで、ヒト由来のGPCRの機能的発現が報告されています。嗅覚受容体は膜タンパク質なので、リポソームを共存させた状態で発現させ、リポソームの膜から可溶化して用います。この嗅覚受容体を半導体センサーに結合させたところ、リガンドの結合に伴うシグナルの検出に成功しました9)。原因は分かりませんが、嗅覚受容体を発現した細胞では、匂い分子に対して応答しますが、実際の嗅覚よりも感度が著しく低いという問題があります。一方、嗅覚受容体を用いたセンサーでは実際の嗅覚に近い感度で検出することができています。無細胞での発現の場合には、RTP依存型の嗅覚受容体の発現も可能であったので、センサーの開発ができることが期待されます。
様々な分野で期待される人工嗅覚センサー
犬の嗅覚は驚異的であり、その感知能力は人間の数千倍から1億倍あると言われています。犬の嗅覚は、例えば、薬物や爆発物の探知、行方不明者や犯罪者の追跡、災害現場での生存者の捜索などに活躍しています。また、医療の分野でも活用が期待されており、がんや低血糖、てんかんの発作などの病気の早期検知に役立つ可能性があります。マウスも優れた嗅覚を有しており、地雷探知での活躍が知られています。嗅覚のメカニズムを解明することで、これらの能力を備えた人工嗅覚センサーの開発が期待されています。
偶然からスタートした嗅覚の研究ですが、多くの成果を出すことができました。そのほとんどが松波先生との共同研究です。歴史的にみても、若手研究者が海外の最先端の研究者と共同研究をすることで、多くの成果を出し、成長しています。私自身は本年度で退職ですが、実際に研究を推進してきた福谷さんや学生たちが今後の嗅覚研究の発展に貢献し、嗅覚センサーが実現することを期待しています。

参考文献
- 1)Buck, L.; Axel, R. A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell. 1991, vol. 65, no. 1, p. 175-187. doi:10.1016/0092-8674(91)90418-x.
- 2)Niimura, Y.; Matsui, A.; Touhara, K. Extreme expansion of the olfactory receptor gene repertoire in African elephants and evolutionary dynamics of orthologous gene groups in 13 placental mammals. Genome Res. 2014, vol. 24, no. 9, p. 1485-1496. doi:10.1101/gr.169532.113.
- 3)Saito, H.; Chi, Q.; Zhuang, H.; Matsunami, H.; Mainland, J. D. Odor coding by a Mammalian receptor repertoire. Sci Signal. 2009, vol. 2, no. 60, ra9. doi:10.1126/scisignal.2000016.
- 4)Saito, H.; Kubota, M.; Roberts, R. W.; Chi, Q.; Matsunami, H. RTP family members induce functional expression of mammalian odorant receptors. Cell. 2004, vol. 119, no. 5, p. 679-691. doi:10.1016/j.cell.2004.11.021.
- 5)Sharma, R.; Ishimaru, Y.; Davison, I.; Ikegami, K.; Chien, M. S.; You, H.; Chi, Q.; Kubota, M.; Yohda, M.; Ehlers, M.; Matsunami, H. Olfactory receptor accessory proteins play crucial roles in receptor function and gene choice. Elife. 2017, vol. 6, e21895. doi:10.7554/eLife.21895.
- 6)Ikegami, K.; de March, C. A.; Nagai, M. H.; Ghosh, S.; Do, M.; Sharma, R.; Bruguera, E. S.; Lu, Y. E.; Fukutani, Y.; Vaidehi, N.; Yohda, M.; Matsunami, H. Structural instability and divergence from conserved residues underlie intracellular retention of mammalian odorant receptors. Proc Natl Acad Sci USA. 2020, vol. 117, no. 6, p. 2957-2967. doi:10.1073/pnas.1915520117.
- 7)Kida, H.; Fukutani, Y.; Mainland, J. D.; de March, C. A.; Vihani, A.; Li, Y. R.; Chi, Q.; Toyama, A.; Liu, L.; Kameda, M.; Yohda, M.; Matsunami, H. Vapor detection and discrimination with a panel of odorant receptors. Nat Commun. 2018, vol. 9, no. 1, p. 4556. doi:10.1038/s41467-018-06806-w.
- 8)Fukutani, Y.; Abe, M.; Saito, H.; Eguchi, R.; Tazawa, T.; de March, C. A.; Yohda, M.; Matsunami, H. Antagonistic interactions between odorants alter human odor perception. Curr Biol. 2023, vol. 33, no. 11, p. 2235-2245, e4. doi:10.1016/j.cub.2023.04.072.
- 9)Yoshii, T.; Takayama, I.; Fukutani, Y.; Ikuta, T.; Maehashi, K.; Yohda, M. Development of an odorant sensor with a cell-free synthesized olfactory receptor and a graphene field-effect transistor. Anal Sci. 2022, vol. 38, no. 2, p. 241-245. doi:10.1007/s44211-022-00073-y.
- 養王田 正文 よおだ まさふみ
- 東京大学工学部化学工学科に在籍しているときにタンパク質に興味を持ち、生命科学の研究をスタートしました。F1-ATPaseという我々の体の中のエネルギー代謝に重要な役割を担っている酵素の研究で工学博士の学位を取得し、旭硝子株式会社(現AGC)の研究員、理化学研究所の研究員を経て、1998年から東京農工大学工学部生命工学科で教育、研究を行っています。本文でも紹介した、嗅覚と分子シャペロンに関する研究の他に、バイオレメディエーションによる土壌地下水浄化に関する研究、遺伝子解析装置の自動化の研究などを行っています。現在は、文部科学省のCOI-NEXTという制度のもと、カーボンネガティブに挑戦する炭素耕作拠点の拠点長として、地球温暖化問題解決のための研究開発を主導しています。

見出しのみを表示する